포커스/기획
포커스Ⅰ

안구 면역 특권(Ocular Immune Privilege): The Precious Gift and Therapeutic Opportunities
이 형 근
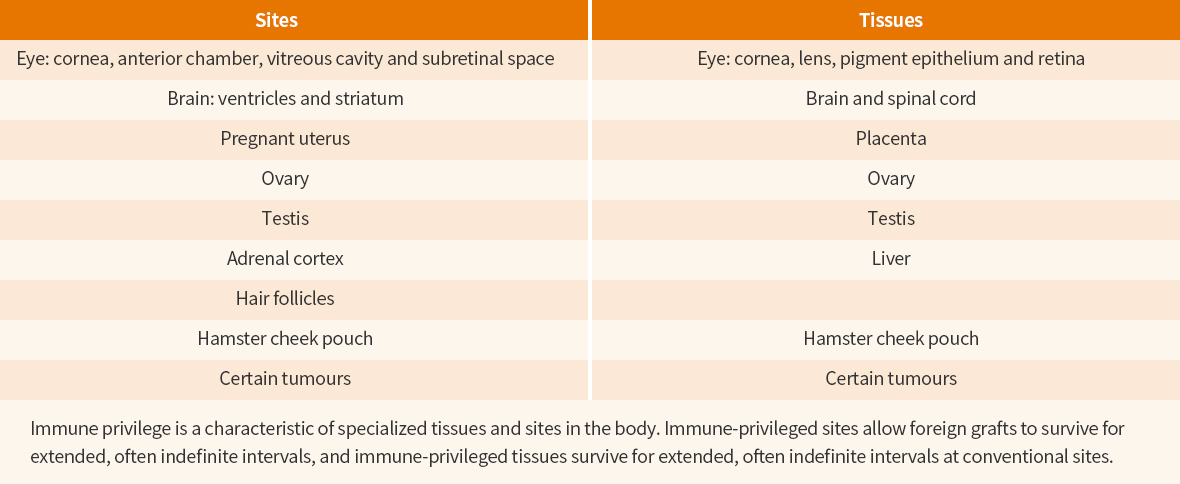
연세의대 강남세브란스병원면역 특권(Immune privilege)라는 말은 현대 면역학 및 이식(Transplantation) 연구의 아버지라고 할 수 있는 Peter Medawar 가 처음 실험을 통해 발견하였다. 제1차 세계대전 당시, 많은 군인들이 화상으로 피부를 잃는 것을 보고 피부이식과 관련한 연구를 진행하다가 토끼에게 동종피부(Allogenic skin)를 안구, 뇌 등에 넣게 되면 피부에 이식하는 것보다 면역거부반응이 약하고 더디게 일어나는 것을 발견하고 그의 제자 Rupert Billingham과 함께 면역 특권을 실험적으로 증명하였다.1,2 눈과 뇌 이외에도 면역 특권을 가진 장기나 조직이 실험을 통해 더 발견되었으며 태반, 난소, 정소, hair follicle 등이이에 속한다(표 1). 최근에는 종양도 면역반응에 대해 상대적으로 저항을 보이는 것으로 알려져 있어서 이 역시 면역 특권을 획득하는 것으로 생각하고 있으며 종양에 대한 면역 특권을 면역회피(Immune deviation)라고 부른다. 종양 관련하여, 배양된 암세포를 동물의 유리체강이나 subretinal space에 넣게 되면 종양세포가 다른 조직에 이식할 때보다 더 빠르게 증식하는 것은 잘 알려져 있으며 이러한 과정에 NK(Natural Killer) cell 기능 부전이 관련되어 있다고 한다. 흥미로운 것은 위의 면역 특권이 생기는 조직들이 생명체의 생존과 번식에 직접 관련한 곳이라는 점이다.
본 연제는 복잡하고 아직 모든 것이 밝혀져 있지 않지만, 최근의 연구들을 통해 눈의 면역관용과 면역 특권이 어떻게 형성되며 이를 어떻게 치료에 이용할 수 있을지 그 가능성에 대해 살펴보고자 한다. 사실, 안구 면역 특권은 대단히 복잡하여 많은 면역학적 세포들과 마커들이 관여하지만 복잡한 내용은 제거하고 간략히 개념적인 부분들을 이야기하고자 한다.
모든 인체의 장기나 조직은 외부의 병원균으로부터 끊임없이 위협을 받는다. 요즘과 같은 COVID19 Pandemic 상황에서는 더 절실히 느낄 수 있을 것이다. 피부나 각막 같은 조직은 외부 병원체의 직접적인 공격에 노출되지만 눈의 안쪽 구조나 신장, 간 등의 내부 장기/조직은 이러한 공격이 혈관과 혈액을 타고 이어진다. 위에 열거한 고환, 난자, 뇌 등과 마찬가지로 눈에는 blood-tissue barrier(Endothelial cell tight junction and pigment epithelial layer tight junction)가 존재하며 이런 구조들은 혈행성 병원체들이 눈으로 퍼지는 것을 막아준다. 하지만, 이런 물리적 방벽은 완전하지 않아서 바이러스로부터 기생충까지 모든 병원체들이 눈에 질병을 일으킬 수 있다.
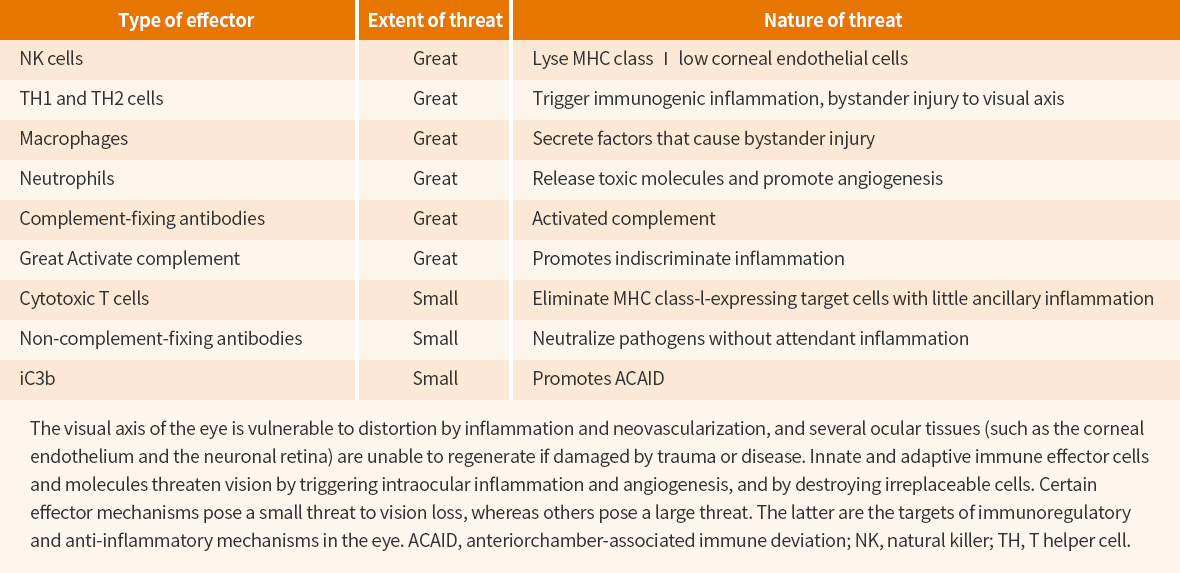
병원체들이 우리 몸의 조직에 성공적으로 침투하기 위해 다양한 전략을 구사하도록 진화된 것과 마찬가지로 면역계(Immune system)는 병원체에 대해, 각각 특이적으로, 중화시킬 수 있는 전략을 발전시켜왔다. 즉, 각 기관은 고유의 염증반응과 면역방어기작을 갖는다는 것이다. 한 기관에 특별한 면역방어체계를 다른 조직에 그대로 적용시킬 경우, 그 조직이 완전히 궤멸할 수 있다. 예를 들면 세균이 우글거리는 장의 면역반응이 눈에 그대로 적용된다면 아주 작은 공격에 대한 면역방어로도 눈은 그 기능을 잃을 것이다. 따라서, 면역계는 각 조직마다 특별하고 조직 손상을 최소화할 수 있도록 방어 기작(Defensemechanism)을 발전시켜왔는데 이러한 과정이 가장 최소화되어 있으며, 대단히 복잡하고 많은 의문을 남기는 장기가 눈과 뇌(Brain)이다. 안구 면역 특권의 소멸과 관련한 중요한 인자들이 표 2에 정리되어 있다.3
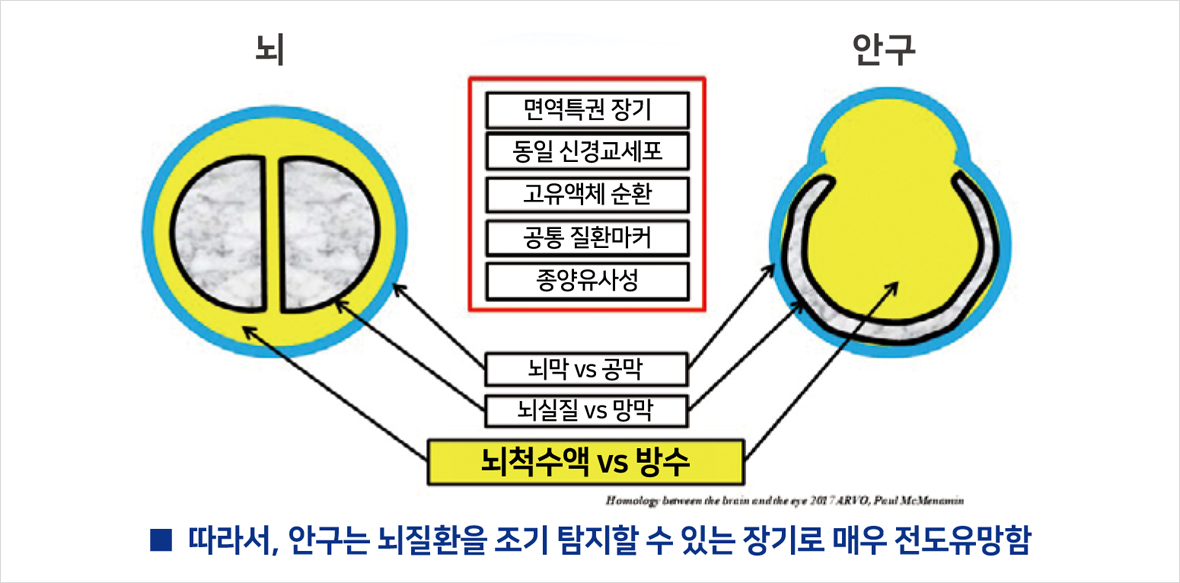
사실, 눈과 뇌는 구조적, 기능적으로 여러 유사성이 많다. 이에 대해서는 지면 관계상 아래 그림으로 설명을 갈음한다(그림 1). 눈, 특히 망막은 대단히 섬세한 조직으로 아주 작은 염증으로도 시기능을 대부분 잃고 재생되거나 회복되는 기능이 거의 없기 때문에 안구 면역 특권은 외부 병원체로부터 눈을 지키고 동시에 시력도 보존하기 위해 섬세한 면역 기작을 발전시켜왔으며 이러한 과정 역시 뇌와 비슷하다. 저자 이외에도 눈과 뇌의 유사성에 대해 오래전부터 관심을 갖고 있으며, 두 조직의 유사성을 통한 중요 질환의 진단에 관한 연구를 진행하고 있는 연구자들은 많이 있다.1
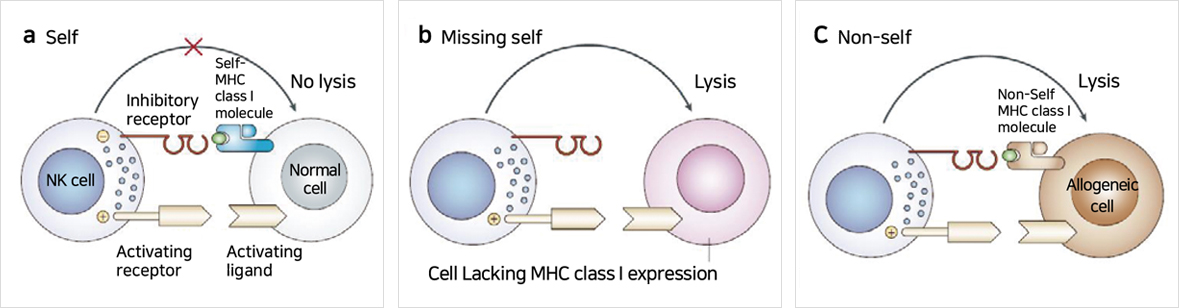
안구 면역 특권은 외부 혹은 내부의 침입으로부터 정상조직을 어떻게 구분할 것인가 로부터 시작한다. 즉, self와 non-self를 구분하는 것이다.
Self와 non-self를 구분하는 기전은 사실 대단히 복잡하고 염증과 면역반응을 구분하는 중요한 포인트이다. 하지만, 여기선 ACAID(Anterior chamber associated immune deviation) system과 연관되어 있고 가장 잘 알려진 NK cell과 MHC class I을 중심으로 간략하게 설명한다. NK 세포는 transformed cell(e.g., cancer cell)과 병원체에 감염된 세포를 제거하는 것이 주된 기능으로 알려져 있으며 대표적으로 IFN-γ를 형성하는 세포로 알려져 있다. NK cell은 개체의 발생단계부터 self를 인지하여 파괴시키지 않도록 교육을 받으며 그림 2에 보이는 대로 정상적으로 모든 세포가 발현하는 self-MHC class I가 있으면 공격하지 않으나 만일 self-MHC class I이 소실되는 종양이나 바이러스 감염 상태가 되면 NK 세포 활성화가 진행된다.3 NK cell의 활성 억제는 ACAID를 유지하는 중심 기전 중 하나로 방수에 풍부한 TGF-β 와 MIF(Macrophage inhibitory factor)에 의해 유지된다.
안구는 대단히 작고 섬세한 조직이기에 면역계의 작은 활성화로도 돌이킬 수 없는 손상을 받을 수 있다. 따라서, 수십 년 전부터 면역 특권의 강화나 면역관용(tolerance)을 유도하려는 시도들을 해오고 있었으나 아직 좋은 결과를 내고 있지는 않다. 하지만, 안구 면역 특권을 이용한 치료는 다음 3가지 정도로 시도되고 있다. 첫째는 ACAID system을 이루는 주 성분인 TGF-β 또는 thrombospondin을 실험실에서 처리하여 regulatory function(Inhibition)을 획득한 T cells을 안구에 주입하는 방법이다(Adjuvant cell therapy). 오래전부터 동물실험은 이런 방법을 써서 여러 자가면역질환에서 성공적으로 치료해왔으나 사람에게 시도된 연구는 아직 없다. 둘째는, RPE, sensory retinal cell을 포함하여 면역 타깃이 되는 안구 조직 세포의 MHC class I의 발현을 조절하거나 면역 반응을 일으킬 수 있는 B7-1(CD80), B7-2(CD86), PD(programmed cell death) 발현을 억제시키는 것이다. 이런 방법은 실제로 corneal allograft 등에서는 실험적으로 이용되고 있다. 마지막으로 ACAID system에 풍성히 존재하는 여러 soluble 한 면역조절물질(e.g., alpha-MSH, CGRP, MIF) 등의 adjuvant injection 혹은 유도를 유발하는 방법이다. 마지막 방법의 경우 반응이 일시적이어서 여러 번 치료가 필요할 수 있다.4.5 안구 면역 관용성(Ocular immune privilege and tolerance)이 발견된 지 이제 100년이 다 되어간다. 포도막과 관련한 염증을 연구하였던 연구자들은 그간 많이 있었지만, 면역 특권을 집중적으로 연구하였던 중요한 연구자들은 Wayne Steinlein, Jerry Niederkorn 정도를 들 수 있을 것이고 이들마저 이제는 다 은퇴하였다. 아쉬운 것은, 아직 많은 것이 미완의 영역으로 남은 안구 면역 특권에 대한 연구를 잇는 좋은 연구자들이 드물다는 것이다. 이는 아마도 대부분의 연구자들이 ‘내게 너무 크고 어려운 연구’라는 생각으로 '미완성' 혹은 '실패하는 연구'로 남는 것을 두려워하기 때문에 연구주제로 잘 선택하지 않는 것이 아닐까 싶다. 처음부터 겁낼 필요는 없다고 생각한다. 미완성이면 어떠랴. 다빈치의 '모나리자', 말러의 10번 교향곡, 푸치니의 '투란도트'가 미완성이지만 훌륭히 남아 있듯이, 짧은 시간에 해낼 수 있는 완성된 ‘쉬운 연구’에 매달리기보다는 미완으로 남더라도 어려운 주제에 도전해 보는 것이 어떨까 한다.
- 1 Michal Schwartz, Anat London, Inbal Benhar. The retina as a window to the brain—from eye research to CNS disorder. Nat Rev Neurol 2013;9:44-53.
- 2 Streilein JW. Ocular immune privilege: therapeutic opportunities from an experiment of nature. Nat Rev Immunol 2003;3:879-889.
- 3 Kumar V and McNerney ME. A new self: MHC-Class-1-independent natural killer cell self-tolerance. Nat Rev Immunol 2005;5:363-374.
- 4 Taylor AW. Ocular immune privilege. Eye 2009;23:1885-1889.
- 5 Zhang J, Stein-Streilein J. Immune Response and the Eye. Therapies based on principles of ocular immune privilege. Chem Immunol Allergy. Basel, Karger, 2007, vol 92, pp317-327.